優秀発表賞New
第61回支部例会の優秀発表賞は、以下の方々(敬称略)が受賞されました。おめでとうございます。小谷友理(京産大・院工)
「もやもや病関連タンパク質mysterinによるzebrafishの発生制御」
吉田亜佑美(京産大・院工)
「VEGF-Aはその受容体NRP1の細胞内領域とGIPC1、Syxとの複合体形成を促進し
RhoAの活性化を介してがん細胞の増殖と浸潤を誘導する」
志田美香(神戸薬科大・院)
「コンドロイチン硫酸受容体を介した神経細胞の極性形成過程の制御機構の解析」
西清人(京大・院医)
「ナルディライジンは膵β細胞においてインスリン分泌を制御する」
森戸大介(京産大・総合生命)
「モヤモヤ病タンパク質ミステリンの構造と解析」
プログラム
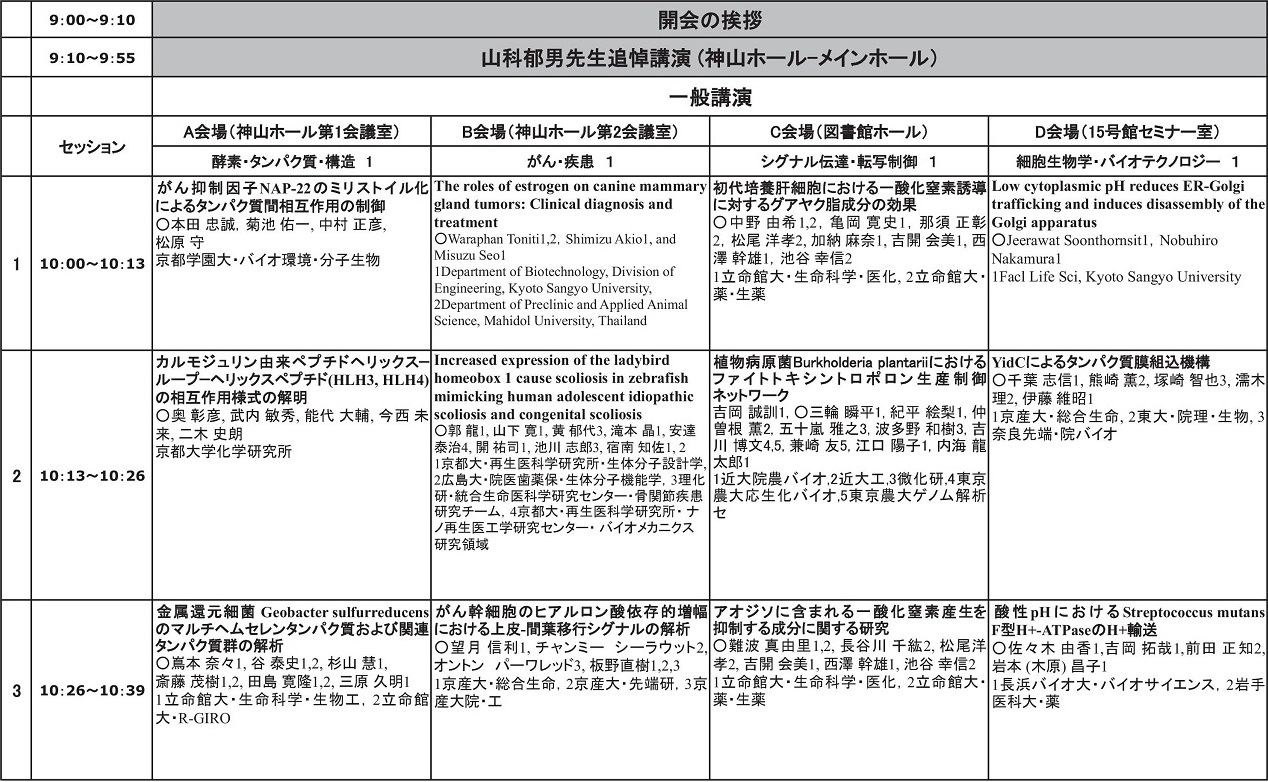
一般講演時間割と会場一覧表(クリックでタイムテーブルのみダウンロードできます。)
講演要旨集(こちらからダウンロードお願い致します。)
山科郁男先生追悼講演

山科郁男先生のご業績を偲んで
-糖質化学から糖鎖生物学へ-
川嵜 敏祐 先生
立命館大学 総合科学技術研究機構
山科郁男先生が本年1月27日にご逝去されました。ご生前のご功績を偲び、
謹んで哀悼の意を表します。
さて、山科郁男先生は、昭和38(1963)年7月、37歳の若さで金沢大学理学部より
京都大学薬学部生物薬品化学講座(のちに 生物化学講座と改称)に、鈴木友二先生の
後任として着任されました。その後の26年間京都大学薬学部において、1989年同大学を
退職された後の7年間京都産業大学工学部において、日本を代表する糖鎖研究者として華々しい
ご活躍を続けられました。少しご経歴をさかのぼりますと、山科郁男先生は、昭和 23年3月
東京大学理学部化学科(左右田徳郎研究室)をご卒業後,東京大学大学院、同助手、
名古屋大学大学院を経て昭和28年7月にはスウェーデン、カロリンスカ研究所に留学、
昭和 32 年に帰国し金沢大学理学部助教授に就任、やがて教授に昇進されています。
カロリンスカ研究所では、山科先生は当時、世界の生化学の指導的立場にあった多くの
スウェーデン学派の碩学と親交を結ばれ、生化学の本流であるタンパク質化学・酵素化学の
研鑽をつまれ、後に自動ペプチドシークエンサーとして完成されていったEdman法による、
フィブリノーゲン-フィブリン変換の機構、さらには酵素エンテロキナーゼによる
トリプシノーゲンからトリプシンへの変換の機構の解明などの画期的成果をあげておられます。
先生は、このとき十二指腸分泌液より精製した酵素エンテロキナーゼが45%に及ぶ糖含量を
持つことに興味を持たれ、糖タンパク質の研究に進まれたと最近執筆された総説に述べて
おられます[1]。先生は糖タンパク質の概念すら確立してない黎明期から数十年間に渡る
糖質研究を通し、終始、先見性に富んだ鋭い洞察力と厳密な実証主義を見事に一体化した研究を
展開され、多くの偉大な業績を残されました。これらの研究は、先述の著書のなかで、
(1) The basic structures of glycoproteins、(2) Characterization of membrane glycoproteins、
(3) Sugar-directed and cancer-associatedmonoclonal antibodies としてまとめられています。
いずれも、新しい時代を切り開く先端的な研究であり、ライフサイエンス全体に強いインパクト
を与えました。これらのご業績に対し、昭和 63年には「細胞膜糖タンパク質の生化学的研究」
により内藤記念科学振興賞を受賞されておられます。また,歴史の浅い薬学の生物系領域に
本格的な生化学の研究・教育の伝統を築き上げられ、多くの優れた門下生を輩出されました。
さらに、この間、日本生化学会会長、日本生化学会会頭、Journal of Biochemistry 編集委員長、
アジア・オセアニア・生化学分子生物学会連合(FAOBMB )の機関誌、Journal of Biochemistry、
Molecular Biology and Biophysics (JBMBB)初代編集長、日本学術会議会員などの要職を
務められ、わが国の基礎生命科学の発展に多大の貢献をなされました。
本講演では、糖質化学から糖鎖生物学へと時代をリードされた山科郁男先生の偉大な
ご業績を偲ぶと共に、その大樹の上に芽吹き、育っている門下生の研究成果についても
ご紹介したいと思います。
[1] Ikuo Yamashina, The trail of my studies on glycoproteins from enterokinase to tumor
markers. Proc.Jpn.Acad.Ser. B 86:578-587(2010)
謹んで哀悼の意を表します。
さて、山科郁男先生は、昭和38(1963)年7月、37歳の若さで金沢大学理学部より
京都大学薬学部生物薬品化学講座(のちに 生物化学講座と改称)に、鈴木友二先生の
後任として着任されました。その後の26年間京都大学薬学部において、1989年同大学を
退職された後の7年間京都産業大学工学部において、日本を代表する糖鎖研究者として華々しい
ご活躍を続けられました。少しご経歴をさかのぼりますと、山科郁男先生は、昭和 23年3月
東京大学理学部化学科(左右田徳郎研究室)をご卒業後,東京大学大学院、同助手、
名古屋大学大学院を経て昭和28年7月にはスウェーデン、カロリンスカ研究所に留学、
昭和 32 年に帰国し金沢大学理学部助教授に就任、やがて教授に昇進されています。
カロリンスカ研究所では、山科先生は当時、世界の生化学の指導的立場にあった多くの
スウェーデン学派の碩学と親交を結ばれ、生化学の本流であるタンパク質化学・酵素化学の
研鑽をつまれ、後に自動ペプチドシークエンサーとして完成されていったEdman法による、
フィブリノーゲン-フィブリン変換の機構、さらには酵素エンテロキナーゼによる
トリプシノーゲンからトリプシンへの変換の機構の解明などの画期的成果をあげておられます。
先生は、このとき十二指腸分泌液より精製した酵素エンテロキナーゼが45%に及ぶ糖含量を
持つことに興味を持たれ、糖タンパク質の研究に進まれたと最近執筆された総説に述べて
おられます[1]。先生は糖タンパク質の概念すら確立してない黎明期から数十年間に渡る
糖質研究を通し、終始、先見性に富んだ鋭い洞察力と厳密な実証主義を見事に一体化した研究を
展開され、多くの偉大な業績を残されました。これらの研究は、先述の著書のなかで、
(1) The basic structures of glycoproteins、(2) Characterization of membrane glycoproteins、
(3) Sugar-directed and cancer-associatedmonoclonal antibodies としてまとめられています。
いずれも、新しい時代を切り開く先端的な研究であり、ライフサイエンス全体に強いインパクト
を与えました。これらのご業績に対し、昭和 63年には「細胞膜糖タンパク質の生化学的研究」
により内藤記念科学振興賞を受賞されておられます。また,歴史の浅い薬学の生物系領域に
本格的な生化学の研究・教育の伝統を築き上げられ、多くの優れた門下生を輩出されました。
さらに、この間、日本生化学会会長、日本生化学会会頭、Journal of Biochemistry 編集委員長、
アジア・オセアニア・生化学分子生物学会連合(FAOBMB )の機関誌、Journal of Biochemistry、
Molecular Biology and Biophysics (JBMBB)初代編集長、日本学術会議会員などの要職を
務められ、わが国の基礎生命科学の発展に多大の貢献をなされました。
本講演では、糖質化学から糖鎖生物学へと時代をリードされた山科郁男先生の偉大な
ご業績を偲ぶと共に、その大樹の上に芽吹き、育っている門下生の研究成果についても
ご紹介したいと思います。
[1] Ikuo Yamashina, The trail of my studies on glycoproteins from enterokinase to tumor
markers. Proc.Jpn.Acad.Ser. B 86:578-587(2010)
特別講演

「タンパク質に潜在する生理活性ペプチドの
多様性とその利用」
吉川 正明 先生
(財)生産開発科学研究所
特定の前駆体タンパク質のみから派生すると考えられていた生理活性ペプチドが、通常の
タンパク質からも派生することが最初に見出されたのは、牛乳β-カゼインに由来するオピオイド
ペプチドβ-casomorphinの発見まで遡る(Brantl et al.1979)。同年、小麦グルテン消化物がオピオ
イド活性を示すことが報告され、我々は3種類のオピオイドペプチドを単離構造決定した。
これを機に、我々は食品をはじめとする各種タンパク質の消化物を探索の対象として選び、
広範なアッセイ系を駆使することにより、動物のみならず植物タンパク質中にも、動物に作用
する多様な生理活性ペプチド配列が潜在することを見出してきた。これらペプチドの一般的特性
としては、内因性ペプチドと共通の多様なレセプターを介して作用し、作用は内因性ペプチド
よりも小さいにも関わらず、経口投与で有効なものがある点である。動物由来のものについては
合目的性が期待されるが、藻類から高等植物に至るまで、すべての植物に共通に含まれるRubisco
や、穀類、豆類等の貯蔵タンパク質中にも同様なペプチドが潜在し、これらに対するレセプター
が動物に出現する遥か以前から存在してきたという事実は、合目的性とは関りなく、ある確率で
生理活性配列が偶然にも存在し得ることを示唆している(天然ライブラリー仮説)。これらの
中には、各種生活習慣病の予防に有効なものも見られる。以下では、これらペプチドに関する
新しい構造-活性相関、強力誘導体の設計ならびに遺伝子変作物での生産、さらには、当初は
予想しなかった成果として、内因性生理活性ペプチドにも共通する新しい生理作用、および
情報伝達経路の発見について述べる。
タンパク質からも派生することが最初に見出されたのは、牛乳β-カゼインに由来するオピオイド
ペプチドβ-casomorphinの発見まで遡る(Brantl et al.1979)。同年、小麦グルテン消化物がオピオ
イド活性を示すことが報告され、我々は3種類のオピオイドペプチドを単離構造決定した。
これを機に、我々は食品をはじめとする各種タンパク質の消化物を探索の対象として選び、
広範なアッセイ系を駆使することにより、動物のみならず植物タンパク質中にも、動物に作用
する多様な生理活性ペプチド配列が潜在することを見出してきた。これらペプチドの一般的特性
としては、内因性ペプチドと共通の多様なレセプターを介して作用し、作用は内因性ペプチド
よりも小さいにも関わらず、経口投与で有効なものがある点である。動物由来のものについては
合目的性が期待されるが、藻類から高等植物に至るまで、すべての植物に共通に含まれるRubisco
や、穀類、豆類等の貯蔵タンパク質中にも同様なペプチドが潜在し、これらに対するレセプター
が動物に出現する遥か以前から存在してきたという事実は、合目的性とは関りなく、ある確率で
生理活性配列が偶然にも存在し得ることを示唆している(天然ライブラリー仮説)。これらの
中には、各種生活習慣病の予防に有効なものも見られる。以下では、これらペプチドに関する
新しい構造-活性相関、強力誘導体の設計ならびに遺伝子変作物での生産、さらには、当初は
予想しなかった成果として、内因性生理活性ペプチドにも共通する新しい生理作用、および
情報伝達経路の発見について述べる。

シンポジウム

我々の生体の恒常性維持には大量のエネルギーを必要とし、それは主に食物に含まれる自由
エネルギーを、ATPに変換することによって効率的に行われている。ATPは解糖系および
ミトコンドリアにおける酸化的リン酸化によって大部分が産生される。体内におけるATPの
要求性は量的にも、時間的にもさまざまに変化するため複雑で巧妙なATP産生の調整系が存在
することが予測される。
解糖系に関しては、代謝経路に関与する酵素が経路の途中で産生される基質により
フィードバック調節されているが、ミトコンドリアの酸化的リン酸化の制御はより複雑で特徴的
である。酸化的リン酸化経路は解糖系のような直線的な酵素反応ではなく、水素から酸素へと
流れる電子伝達のエネルギーをまずミトコンドリア内膜を挟んだプロトン勾配に変換する。
次に、作成されたプロトン勾配により得られる位置エネルギーは、プロトンが内膜を通過する
際にATP合成酵素ナノモーターの回転力に変換されATPが産生される。電子伝達を含めたこれら
の過程には実に100以上ものタンパク質が関与し、ATPの不足を感知した際には、電子伝達を
素早く、もれなく上昇させる堅牢なシステムを構築している。
生体内で唯一酸素を消費するこのシステムは、嫌気性細菌より好気的細菌に進化した個体の
寄生により誕生したとされているミトコンドリアの機能を進化的に考慮するうえでも大変興味
深い。すなわち、細菌の電子伝達系に比べて、ミトコンドリアの電子伝達系ははるかに多くの
タンパク質から構成されている。これらの新たに進化の過程で追加されたミトコンドリア酸化的
リン酸化タンパク質は、電子伝達系の堅牢性を維持し、電子が酸素に受け渡される過程が不完全
に行われることを防ぐために構成されたと考えられる。それゆえにその機能を直接動的に制御
する分子の存在は否定されてきた。しかし<酵母のような下等生物からさらに脊椎動物のような
閉鎖血管系を有する複雑な臓器複合体を形成する生物に進化する過程で、さらに酸化的リン酸化
の機能を制御する分子が誕生したことは十分想定される。そしてそれらはおそらく、高次機能を
持つ臓器が低酸素等にさらされやすいという構造的特徴に起因する可能性が高い。
我々は、このミトコンドリアにおける堅牢な酸化的リン酸化システムを動的に制御する分子を
同定した。このクローニングには、ATPの産生を正確に評価するシステムの確立が必須であり、
その過程においてATP産生速度およびATP利用度を生体内で測定することの重要性を見出した。
そして本因子が、ATP産生効率を上昇させ、臓器をエネルギー代謝不全から保護するために
重要な働きをする脊椎動物特有の分子であることを見出した。
本講演では、新しいATPイメージング法を使用した分子クローング手法の紹介と、
同定された分子の機能解析を通じて、ATP産生増強剤の臨床応用も視野にいれた最近の
研究成果を紹介したい。
エネルギーを、ATPに変換することによって効率的に行われている。ATPは解糖系および
ミトコンドリアにおける酸化的リン酸化によって大部分が産生される。体内におけるATPの
要求性は量的にも、時間的にもさまざまに変化するため複雑で巧妙なATP産生の調整系が存在
することが予測される。
解糖系に関しては、代謝経路に関与する酵素が経路の途中で産生される基質により
フィードバック調節されているが、ミトコンドリアの酸化的リン酸化の制御はより複雑で特徴的
である。酸化的リン酸化経路は解糖系のような直線的な酵素反応ではなく、水素から酸素へと
流れる電子伝達のエネルギーをまずミトコンドリア内膜を挟んだプロトン勾配に変換する。
次に、作成されたプロトン勾配により得られる位置エネルギーは、プロトンが内膜を通過する
際にATP合成酵素ナノモーターの回転力に変換されATPが産生される。電子伝達を含めたこれら
の過程には実に100以上ものタンパク質が関与し、ATPの不足を感知した際には、電子伝達を
素早く、もれなく上昇させる堅牢なシステムを構築している。
生体内で唯一酸素を消費するこのシステムは、嫌気性細菌より好気的細菌に進化した個体の
寄生により誕生したとされているミトコンドリアの機能を進化的に考慮するうえでも大変興味
深い。すなわち、細菌の電子伝達系に比べて、ミトコンドリアの電子伝達系ははるかに多くの
タンパク質から構成されている。これらの新たに進化の過程で追加されたミトコンドリア酸化的
リン酸化タンパク質は、電子伝達系の堅牢性を維持し、電子が酸素に受け渡される過程が不完全
に行われることを防ぐために構成されたと考えられる。それゆえにその機能を直接動的に制御
する分子の存在は否定されてきた。しかし<酵母のような下等生物からさらに脊椎動物のような
閉鎖血管系を有する複雑な臓器複合体を形成する生物に進化する過程で、さらに酸化的リン酸化
の機能を制御する分子が誕生したことは十分想定される。そしてそれらはおそらく、高次機能を
持つ臓器が低酸素等にさらされやすいという構造的特徴に起因する可能性が高い。
我々は、このミトコンドリアにおける堅牢な酸化的リン酸化システムを動的に制御する分子を
同定した。このクローニングには、ATPの産生を正確に評価するシステムの確立が必須であり、
その過程においてATP産生速度およびATP利用度を生体内で測定することの重要性を見出した。
そして本因子が、ATP産生効率を上昇させ、臓器をエネルギー代謝不全から保護するために
重要な働きをする脊椎動物特有の分子であることを見出した。
本講演では、新しいATPイメージング法を使用した分子クローング手法の紹介と、
同定された分子の機能解析を通じて、ATP産生増強剤の臨床応用も視野にいれた最近の
研究成果を紹介したい。

がん抑制遺伝子RBは多くの悪性腫瘍で、特にタンパク質レベルで失活している。この点に
着目し、RBに焦点を絞ったがんの予防、診断、治療に関するトランスレーショナルリサーチを
行ってきた。
その中で、「RB再活性化スクリーニング」という独自の分子標的薬のスクリーニング系を
考案し、製薬会社と共同で分子標的薬を見出してきた。
RBを活性化するCDK阻害因子p15の発現を上昇させる薬剤スクリーニングを、
JT医薬総合研究所に提案し実行した結果、新規MEK阻害剤trametinibを見出した。trametinibは、
進行性BRAF変異メラノーマ患者を対象に、昨年5月に米国FDAより認可された。さらに今年に
入り、trametinibとBRAF阻害剤dabrafenibの同疾患に対する併用も米国FDAにより認可された。
その結果、旧来の抗がん剤では、進行性BRAF変異メラノーマ患者に対する奏効率は約5%
であったのに対し、trametinibとdabrafenibを併用することにより奏効率は76%にまで向上し、
かつ完全奏効も9%の患者に見られた。
これらの成果により、trametinibはBritish Pharmacological Societyから、Drug Discovery of
the Yearに選ばれた。今回は、私のRB再活性化スクリーニングからtrametinibの発見に至った
経緯に関して紹介したい。
着目し、RBに焦点を絞ったがんの予防、診断、治療に関するトランスレーショナルリサーチを
行ってきた。
その中で、「RB再活性化スクリーニング」という独自の分子標的薬のスクリーニング系を
考案し、製薬会社と共同で分子標的薬を見出してきた。
RBを活性化するCDK阻害因子p15の発現を上昇させる薬剤スクリーニングを、
JT医薬総合研究所に提案し実行した結果、新規MEK阻害剤trametinibを見出した。trametinibは、
進行性BRAF変異メラノーマ患者を対象に、昨年5月に米国FDAより認可された。さらに今年に
入り、trametinibとBRAF阻害剤dabrafenibの同疾患に対する併用も米国FDAにより認可された。
その結果、旧来の抗がん剤では、進行性BRAF変異メラノーマ患者に対する奏効率は約5%
であったのに対し、trametinibとdabrafenibを併用することにより奏効率は76%にまで向上し、
かつ完全奏効も9%の患者に見られた。
これらの成果により、trametinibはBritish Pharmacological Societyから、Drug Discovery of
the Yearに選ばれた。今回は、私のRB再活性化スクリーニングからtrametinibの発見に至った
経緯に関して紹介したい。

近年、がんが特異的に示す代謝を標的とした抗がん剤が注目されており、がんの代謝を
解明しようとする研究が精力的に行われている。
演者らは、キャピラリー電気泳動-質量分析計(CE-MS)を開発し、細胞内に数千種類存在する
低分子代謝産物(メタボローム)の一斉分析を世界に先駆けて実現した[1,2]。現在この方法論を
用いて、がんの代謝の全容解明を目指している。これまでに、CE-MSメタボロミクス法を各種の
がん患者から採取した正常およびがん組織に応用し、がんで特異的に亢進している代謝経路を
明らかにした[3]。また、Oxford大との共同研究によって, がん抑制遺伝子である
フマル酸ヒドラターゼの変異によって蓄積したフマル酸が転写因子NRF2を安定化させて
酸化ストレス防御遺伝子群を発現させたり[4]、クエン酸回路の酵素であるアコニターゼを
阻害したり[5]、代謝産物に結合して尿素回路を阻害していること[6]などを見出した。
本講演では、がんの代謝研究の基礎からメタボロミクスで得られた最新の知見を紹介したい。
参考文献*
1. Soga T. et al. J.Proteome Res. 2, 488-494, 2003.
2. Soga T. et al. J.Biol. Chem. 281, 16768-16776, 2006.
3. Hirayama A. et al. Cancer Res. 69, 4918-4925, 2009.
4. Adam J. et al. Cancer Cell 20, 524-537, 2011.
5. Ternette N. et al. Cell Rep. 3, 689-700, 2013.
6. Adam J. et al. Cell Rep. 3, 1440-1448, 2013.
解明しようとする研究が精力的に行われている。
演者らは、キャピラリー電気泳動-質量分析計(CE-MS)を開発し、細胞内に数千種類存在する
低分子代謝産物(メタボローム)の一斉分析を世界に先駆けて実現した[1,2]。現在この方法論を
用いて、がんの代謝の全容解明を目指している。これまでに、CE-MSメタボロミクス法を各種の
がん患者から採取した正常およびがん組織に応用し、がんで特異的に亢進している代謝経路を
明らかにした[3]。また、Oxford大との共同研究によって, がん抑制遺伝子である
フマル酸ヒドラターゼの変異によって蓄積したフマル酸が転写因子NRF2を安定化させて
酸化ストレス防御遺伝子群を発現させたり[4]、クエン酸回路の酵素であるアコニターゼを
阻害したり[5]、代謝産物に結合して尿素回路を阻害していること[6]などを見出した。
本講演では、がんの代謝研究の基礎からメタボロミクスで得られた最新の知見を紹介したい。
参考文献*
1. Soga T. et al. J.Proteome Res. 2, 488-494, 2003.
2. Soga T. et al. J.Biol. Chem. 281, 16768-16776, 2006.
3. Hirayama A. et al. Cancer Res. 69, 4918-4925, 2009.
4. Adam J. et al. Cancer Cell 20, 524-537, 2011.
5. Ternette N. et al. Cell Rep. 3, 689-700, 2013.
6. Adam J. et al. Cell Rep. 3, 1440-1448, 2013.
