組換えタンパク質発現効率の改善 ~翻訳開始領域コドン置換による~
![]() 組換えタンパク質発現効率の改善 ~翻訳開始領域コドン置換による~
組換えタンパク質発現効率の改善 ~翻訳開始領域コドン置換による~
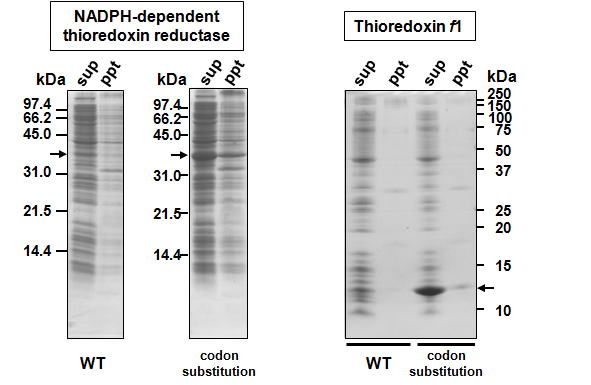
| タンパク質の機能解析をin vitroで行う場合、組換えタンパク質を大腸菌で発現し、精製して用いることが一般的です。 このとき、タンパク質の発現量が多いと精製が容易となり、一度に調製可能なタンパク質の量も増加します。 大腸菌での組換えタンパク質発現を向上させるために、T7 promoterシステムをはじめ様々な手法が開発されています。 しかし、これらのシステムを使用してもタンパク質が期待していたほど発現しないこともあります。 タンパク質発現量を改善する対策として、組換えタンパク質の翻訳開始領域下流のコドンをA/T-richに変更する方法があります。 私達の研究室での成功例を示します。N末端側のアミノ酸残基を保持したままコドンを置換しました。翻訳開始領域のDNA配列をA/T-richに変更した結果、タンパク質の発現量が大きく増加しました。 |
|||
 |
|||
 |
|||
| 詳細は、以下の文献を参照ください。 Ken MOTOHASHI and Yuki OKEGAWA "Method for enhancement of plant redox-related protein expression and purification for in vitro reduction of chloroplastic thioredoxins" Protein Expr. Purif. 101, 152-156 (2014) タンパク質発現量が増加する理由は、目的タンパク質の翻訳開始領域下流をA/T-richに変更することでmRNAの二次構造形成を防ぎ、翻訳の効率を上げるためと考えられています。 注意点 ※N末端側7-10アミノ酸について、アミノ酸残基を保存したまま塩基をG/CからA/Tへ置換し、翻訳開始領域下流をA/T-rich配列にします。コドン置換を行いA/T-rich配列に変更するDNAは長い方が良いと考えられますが、プラスミド構築の際、PCRプライマーが長くなりすぎないように注意します。 ※可能な範囲で、大腸菌のマイナーコドンを避けます。 ※この方法に基づき翻訳開始領域をA/T-richにしても、発現効率が改善されないこともあります。 |
|||
| Method for enhancement of recombinant protein expression in Escherichia coli (in English) |
|||
 |
||||
| Return to "Technical tips" | ||||
| E-mail: |