研究内容
大学院生・研究者向けの詳細な紹介
学部生向けの説明はこちら
タンパク質の誕生:情報が生命へと変換される瞬間
タンパク質は、リボソームの活性中心であるpeptidyl transferase center (PTC) において、アミノ酸が一つずつ繋がる事で合成されます。新しく合成されたポリペプチド鎖は、リボソーム大サブユニットにあるペプチド鎖出口トンネルを通って細胞質へと顔を出します。このポリペプチド鎖の伸長反応の過程で、バクテリアの場合、通常、1秒間におよそ10から20アミノ酸残基分のポリペプチド鎖が合成されます。合成途上のタンパク質は、純粋なポリペプチド鎖ではなく、C末端にtRNAを共有結合した「ペプチジルtRNA」の状態でリボソームにアンカーされています。mRNA上の終止コドンがリボソームに解読されることをきっかけに、この共有結合が翻訳終結因子の作用により加水分解を受け、ポリペプチド鎖部分がリボソームからリリースされます。これが合成完了直後のタンパク質です。
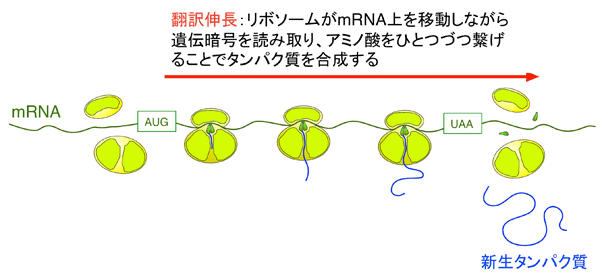
翻訳途上で働くタンパク質
タンパク質の機能発現には、全長の合成と、立体構造の形成が必要です。intrinsic disordered proteinと呼ばれている明確な構造をとらないとされるタンパク質もありますが、それらも、少なくとも、タンパク質全長の合成が完了し、リボソームからリリースされた後に機能すると理解されているはずです。ところが私たちは、最近になって、自らの翻訳伸長を途中で一時停止(アレスト)させることで、翻訳途上の状態で機能するタンパク質(正確には、ペプチジルtRNAと言うべきかもしれませんが)を見出しました。枯草菌で見出し、我々がMifM(Membrane insertion/folding monitor)と命名したこの因子は、C末端付近にユニークなアミノ酸配列(アレストモチーフと呼びます)を持ち、この領域が合成直後にリボソームの出口トンネルの成分と相互作用することで、自らの翻訳伸長にブレーキをかけるという興味深い性質を持つことが分かりました。さらに、N末端には、膜貫通領域(TM)を持ち、この領域がYidC(SpoIIIJ)と呼ばれる膜組込装置(詳細は後述します)によって細胞質膜へと挿入されると、そのことをきっかけに、この翻訳アレストが解除されます。MifMは、この性質を巧妙に利用し、膜組込装置SpoIIIJの活性をモニタリングし、活性低下を感知したときには自身の翻訳アレストを介して、もう一つのYidCホモログ(YidC2)の合成を誘導するのです。MifMの働きにより、枯草菌細胞は、膜組込装置の全体としての活性を一定に維持することが出来るのです。
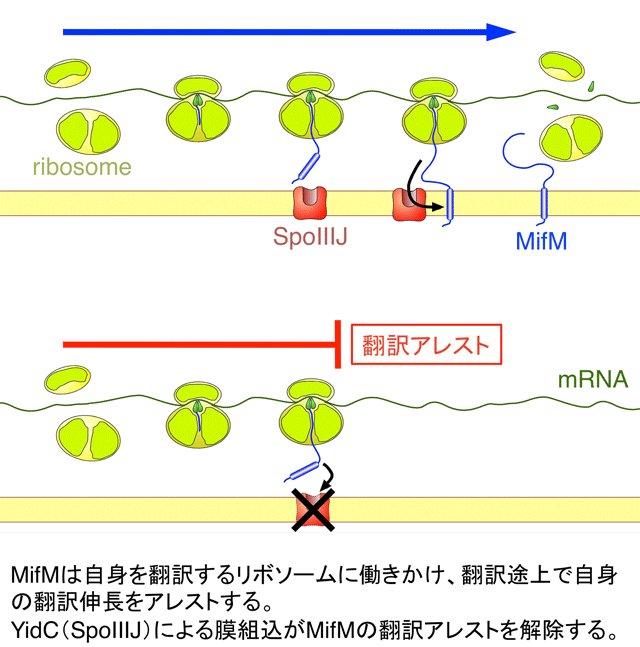
MifMは「制御された翻訳アレスト」を利用して翻訳途上でYidCの活性をモニタリングする
なぜMifMにそのような仕事が可能なのか、さらに詳しく説明します。YidCと呼ばれるタンパク質膜組込装置は、そのホモログがバクテリアから人まで幅広く保存されています。例えば、ミトコンドリアには、Oxa1やCox18と呼ばれるホモログがあり、植物の葉緑体にはAlb3やAlb4と呼ばれるYidCホモログがあります。タンパク質膜組込装置としての分子機構の詳細については、後述します。私たちが実験材料に用いている枯草菌には、二つのYidCホモログがあります。恒常的に発現しているSpoIIIJ(YidC1)と、普段はほとんど発現していないYidC2(YqjG)です。このうち片方を欠失しても枯草菌は生育できますが、両方欠失すると致死になります。つまり、細胞にとってYidCの働きは生育に必須です。私がポスドク時代に所属していたUCSDのKit Pogliano研では、spoIIIJ遺伝子を欠失することで、YidC2の合成が誘導されることを、ポスドクのAileen Rubioさんが見つけていました。しかし、その分子機構は全く明らかにされていませんでした。私はこの問題を取り上げ、やがて、yidC2遺伝子の上流にあるyqzJという遺伝子に着目するに至りました。これが、のちに我々がmifMと我々が命名した遺伝子です。
我々が行った様々な遺伝学的解析から、次のようなモデルが見えてきました。まず、yidC2は、翻訳レベルで制御を受けていることが分かりました。その翻訳開始に必要なSD(Shine-Dalgarno)配列が、通常はmRNAの二次構造でマスクされており、それによって翻訳開始が抑制されています。同じオペロンメンバーであるmifMのORFはyidC2遺伝子の上流にあり、その3’末端領域がmRNAの二次構造と一部オーバーラップしていました。そのため、mifMをリボソームが翻訳しながらmRNA上を移動すると、mifM遺伝子の3’末端付近を翻訳するときに、mRNAの二次構造を解裂することになります。これにより、yidC2のSD配列が露出し、細胞質にあるリボソームが、yidC2の翻訳を開始できるようになります。さらに、合成中のMifMのC末端領域が、自身を合成するリボソームのトンネル成分と相互作用することで翻訳伸長をアレストさせると、mRNA上で停止させられたリボソームは、mRNAの二次構造をOPEN状態に保つことになります。その結果、SD配列がアクセス可能な状態で維持されるため、YidC2の合成が持続します。すなわち、翻訳アレストが起こるとYidC2合成のスイッチがONになるというわけです。MifMは、常に翻訳アレストを起こしているわけではありません。MifMのN末端には膜貫通領域があり、これがSpoIIIJと相互作用して細胞質膜へと挿入されると、そのことをきっかけに、翻訳アレストが解除されます。翻訳アレストが解除されると、mifM遺伝子上のリボソームは、MifMの合成を完了し、mRNA上から解離します。その結果、mRNAの二次構造は再び形成され、YidC2の合成はOFFになります。つまり、細胞内に十分量のSpoIIIJが存在していると、MifMの翻訳アレストはSpoIIIJの働きで速やかに解除され、YidC2の合成は抑制されます。逆に、何らかの理由でSpoIIIJの活性が低下すると、MifMの翻訳アレストは持続し、その間、YidC2の合成が行われます。MifMは、「制御された翻訳アレスト」というユニークな分子機構を利用することで、翻訳の途上で膜組込装置を監視するセンサーとして働くのです。MifMの発見は、タンパク質膜組込装置をモニターするアレスト因子としての初めての、そして、現在でも唯一の報告例です。
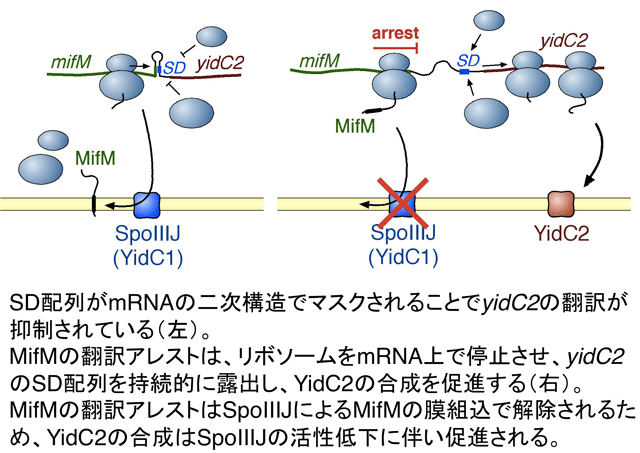
様々な生物種が翻訳アレストを利用したしくみを持つ。
制御された翻訳アレストを利用した遺伝子発現制御の例はMifMが最初の報告例ではありません。例えば、大腸菌では、タンパク質の分泌(膜透過)をモニターするSecMという因子が以前に見出されていました。これは、私が京大ウイルス研にあった伊藤維昭研究室で学生であった頃、同期の学友であった中戸川仁氏(現・東工大准教授)が発見しました。その他にも、ある特定のアミノ酸や抗生物質が存在すると翻訳アレストを引き起こし、ターゲットの遺伝子(アミノ酸代謝酵素や抗生物質耐性因子をコードする遺伝子など)の発現を誘導するタイプのものも見出されています。真核細胞や動物細胞、植物細胞にも、翻訳アレストを巧妙に利用して仕事をする因子が存在することが明らかにされつつあります。このことは、翻訳途上で働くタンパク質という存在が、生物種を超えて普遍的なものであることを示唆しており、同時に、生物学的文脈によって多様な機能を発揮することを示しています。
翻訳アレスト研究から見えてきたもの
これらの一連の翻訳アレストの研究は、これまで盲点であった翻訳伸長の途上で起こるイベントの重要性に光を当てました。翻訳伸長は一定の速度で進むのではなく、緩急をつけて進行すること、また、そのことが、細胞の機能を調節する多様なしくみを生み出すこと、翻訳途上鎖はただ受動的に合成されるわけではなく、自らの合成速度を自律的に調節することで、自己構築の運命決定に自ら主体的に関与しうること、また、新生ポリペプチド鎖とタンパク質局在化装置などの細胞装置との相互作用が、翻訳伸長の速度をフィードバック制御しうること、その性質を利用して、細胞装置をモニタリングするセンサーが構築可能であることなど、幾つかの新しい概念が翻訳アレスト因子の研究から生まれてきました。中でも、翻訳途上で機能する因子がある、という点は、これまでのタンパク質研究の常識の枠をはみ出すユニークは発見であり、遺伝情報の機能発現の新しいありかたを示したものと言えます。
新生ポリペプチド鎖が主役を演じる生命現象
私たちは、翻訳途上で機能する因子を発見したことをきっかけに、「翻訳途上の新生ポリペプチド鎖が主体的に細胞機能の調節に関与する現象」に興味を持っています。タンパク質のバイオジェネシスの過程において、翻訳途上での動的挙動が、タンパク質の局在化や成熟といったその後の運命を左右することも少しずつ知られてきています。また、mRNAの品質管理においても、異常mRNAの翻訳の結果生じたプロダクトである新生ポリペプチド鎖が、品質管理機構への異常mRNAの提示に重要な役割を果たす場合もあるのかも知れません。翻訳が、単に遺伝情報をアミノ酸配列へと変換するだけの過程であるという認識が、今、変わりつつあります。もしかしたら私たちは、翻訳の真の姿を、まだ一部しか見ていないのかも知れません。
翻訳アレスト因子の研究ツールとしての可能性
細胞内でタンパク質の局在化装置をモニターするアレスト因子は、蛋白質局在化装置の活性を測定するための研究ツールとしても注目に値します。一例として、最近私たちが共同研究により明らかにした、タンパク質膜組込装置YidCの分子機構について紹介します。
タンパク質の膜組込:SecチャネルとYidC
タンパク質の膜への組込は、端的に言えば、疎水性に富んだ膜貫通領域を、やはり疎水的環境である脂質二重膜中に埋め込む過程です。しかしながら、その過程は多くの場合、自発的には進行しません。なぜならば、親水性に富んだ細胞外ドメインを、脂質二重膜を超えて反対側へと送り込む必要があるためです。親水的なポリペプチド鎖が疎水的な脂質二重膜を超えて反対側へと送られる過程はエネルギー的な障壁を越える必要があります。そのために、細胞は、トランスロコンと呼ばれる蛋白質性のチャネルを使ってこの障壁を乗り越えるわけです。
Secチャネルに依存した膜組込経路
最も汎用性の高いトランスロコンはSec複合体であり、細菌の場合、SecY、SecE、SecGの3つの膜タンパク質が複合体を形成して膜透過チャネルを形成します。このチャネル構造はSecYの10本の膜貫通領域で形成されており、SecEはSecYチャネルの安定化、SecGは補佐的な機能を持つとされています。SecYEGチャネルは、膜を貫通する垂直方向の通り道を形成するとともに、脂質二重層へと開閉可能な、横向きのゲート(ラテラル・ゲート)を持っています。膜タンパク質の細胞外ドメインは、このチャネルを通って細胞外へと送られ、また、膜貫通領域は、チャネルに挿入されたのち、ラテラル・ゲートから脂質二重層へと移行します。このSecチャネルは、分泌タンパク質の膜透過チャネルも兼ねており、また、すべての生物で保存されています。実に、大小さまざまな膜タンパク質がSecチャネルによって膜組込されます。
Sec複合体に依存しないタンパク質膜組込(YidC経路)
ところが、一部の膜タンパク質は、YidCと呼ばれる別の膜組込装置によって膜内へと挿入されます。このYidCは、前述したとおり、細菌からヒトまで幅広く保存されています。例えば、ミトコンドリアには、Oxa1やCox18と呼ばれるホモログがあり、植物の葉緑体にはAlb3やAlb4と呼ばれるYidCホモログがあります。Secチャネルと比べると、基質の「えり好み」が激しく、これまで知られている基質はいずれも膜を一回もしくは二回貫通する膜タンパク質のみです。また、細胞外ドメインが大きなものは、YidCの基質にはならないようです。一方で、YidCは、Sec経由で膜組込されたタンパク質が膜内で正しくフォールディングしたり、複合体を形成したりする過程で、シャペロンとして機能しているとの報告もあります。Sec複合体自体にこのようなシャペロン機能はないため、YidCは、膜タンパク質のバイオジェネシスの過程でSec複合体とは異なる独自の貢献をしていると言えます。
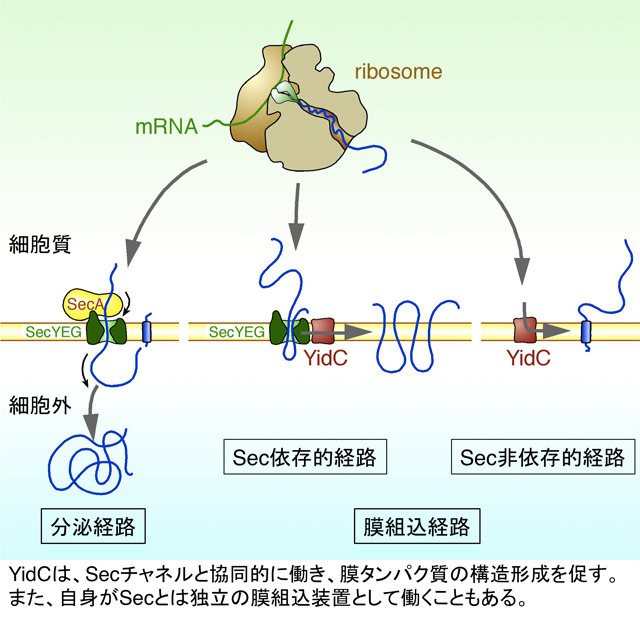
少しずつ見えてきたYidCの“真の姿”
Secチャネルの結晶構造が2004年を皮切りに、アーキア及びバクテリアのホモログについて解かれたのに対し、YidCのコアの部分の結晶構造は、最近まで明らかにされていませんでした。そのため、低解像度の電子顕微鏡像を手がかりとした次のようなモデルが提唱されていました。すなわち、YidCは、多くの場合、五回膜貫通型ですが、ダイマーを形成することで、Secチャネルと同様に、10本の膜貫通領域で一つのチャネル構造を形成するというモデルで、dimeric insertion poreモデルと呼ばれていました。
ところが、最近になって、東大の濡木理教授・奈良先端大の塚崎智也准教授のグループが、Bacillus haloduransのYidCホモログの結晶構造を解明したところ、YidCは、Secチャネルとは異なるユニークな構造をしていることが分かりました。モノマーで結晶化されたその構造を見ると、YidCには、5本の膜貫通領域からなる一つの溝があり、その溝は、細胞質側と、脂質二重層に向かう横方面に対して口を開けている一方、細胞外方向へは閉じているというものでした。この結果は、仮にこのような形のYidCがダイマーを形成しても、細胞外側が閉じているため、以前提唱されたような膜を貫通する孔を形成するとは考えづらいという予想外のものでした。また、その溝の内側は親水性残基が点在しており、さらに、中央に存在するアルギニン残基により、正電荷を帯びていることが予測されました。
では、YidCは、チャネルを形成することなく、どのような機構でタンパク質の膜組込を駆動しているのでしょうか?その問題を解くため、私たちは、枯草菌のmifM-yidC2システムを利用した遺伝学的解析を行いました。yidC2-lacZ translational fusion遺伝子は、SpoIIIJの機能低下に呼応して発現し、細胞内ベータ・ガラクトシダーゼ活性を上昇させます。このことを利用してSpoIIIJの変異解析を行ったところ、YidCが膜内に形作るこの溝の内側の正電荷の重要性が見出されました。次いで、基質膜タンパク質であるMifMの細胞外ドメインおよび膜貫通領域内にある酸性アミノ酸残基も膜組込に重要な役割を果たしていることが分かりました。この一連の共同研究から、私たちは、YidCが膜内に作り出すその溝が、これから膜挿入されようとするタンパク質一時的な受け皿として働くのではないかと考えました。すなわち、その溝の正電荷が、基質膜タンパク質分子内の負電荷をいったん引きつけ、その作用によって膜タンパク質を膜内へと導くというモデルを提唱するに至りました。つまり、YidCは、Secチャネルとは異なるメカニズムでタンパク質を膜挿入していたのです。YidCとSecチャネルの個性の違いも、幾つかは、このメカニズムの違いで説明できるようになりました。
