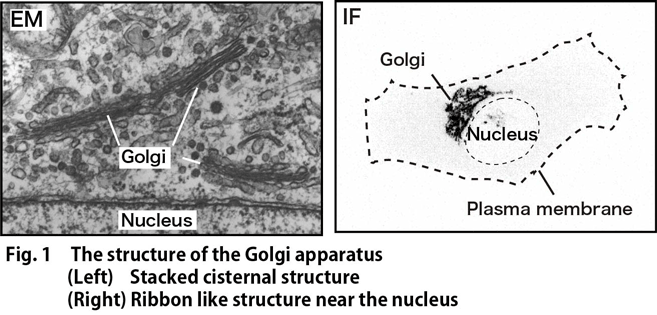
ゴルジ体は,分泌経路の中央に位置する細胞小器官であり,小胞体で新規合成されたタンパク質を受け取り,糖鎖や硫酸基の付加やペプチド鎖の切断などの修飾を行い,リソソームや細胞膜などの目的地に応じて選別し発送する機能を担っている。ゴルジ体の存在と機能は,単細胞の酵母や原生生物から,多細胞の植物・動物までほとんどの真核生物に保存されている。ゴルジ体は,嚢あるいは槽と呼ばれるリン脂質二重層で覆われた袋状の構造物であり,ほとんどの脊椎動物や高等植物では,扁平な形状の槽が積み重なった層板構造を取っている(Fig.1左)。さらに脊椎動物では,層板が側方で繋がりあってリボン状の高次構造を形成している(Fig.1右)。当研究室では,このゴルジ体の構造形成の分子機構と,構造の生理的意義の理解を目指して研究を進めている。

ゴルジ体は,分裂期に解体され,娘細胞に均等に分配されたのちに再構成される。これまでに我々は,ゴルジ体の解体分散がGM130のリン酸化によって引き起こされることを明らかにした(Nakamura et al., Cell 89 p445, 1997)。また一方,ゴルジ体の解体分散は分裂期の進行に必須の役割を持っていることも明らかにした(Yoshimura et al. J. Biol. Chem. 280 p23048, 2005)。さらに,間期のゴルジ体は中心体付近の微小管に絡むようにして局在しており,ゴルジ体の再構成は,細胞運動時に進行方向を変化させるために重要であること,また,GM130のパートナータンパク質であるGRSASP65のリン酸化がこのゴルジ体の再構成に重要であることも明らかにしている(Bisel et. al. J. Cell Biol. 182 p837, 2008)。
最近の研究から,ゴルジ体の構造や機能の不全がアミロイド繊維形成を誘導してアルツハイマー病やALS(筋萎縮性側索硬化症)などの神経変性疾患を導く可能性や,ゴルジ体に局在するタンパク質群が細胞骨格や細胞極性の調節,また,細胞内情報伝達系の調節に関与しており,これらのタンパク質の機能不全が,細胞の癌化に関わることなどが次々と明らかになってきた。これらのゴルジ体の構造変化や機能不全から生じる疾患は,「ゴルジ体病」と名づけられ,その研究が注目を集めている(中村暢宏 生化学90 p21, 2018)。培養細胞やゼブラフィッシュを用いた研究から,細胞レベル,そして個体レベルでのゴルジ体やGM130,GRASP65, YIPF(Yip domain family: 後述)などの機能を明らかにすることで,癌や神経変性疾患などの各種疾患の病理の解明や新規治療標的の発見が期待される。
YIPFタンパク質群は我々が2003年に同定したゴルジ体に局在する複数回膜貫通タンパク質群であり,GM130やGRASP65と協調してゴルジ体へのタンパク質局在や構造維持に機能している可能性がある。Saccharomyces cerevisiaeには,Yip1p, Yif1p, Yip3p, Yip4pの4種のYIPFが存在し,一方,ヒトYIPFでは,YIPF1~6, YIP1B, YIF1A, YIF1Bの9種が存在する。また,Saccaromyces cerevisiaeのYip1pおよびYif1pのホモログがペアとなって複合体を形成する(Yoshida, Y., et al. Exp. Cell Res. 314, 3427−3443,2008; Tanimoto, K. et al., Cell Struct. Funct. 36, 171−185, 2011; Soonthornsit, J., Exp Cell Res, 353, 100-108, 2017)。ヒトYIPFは,3種の独立した複合体1~3を形成し,それぞれゴルジ体上流(ERGIC),中流(cis-Golgi),下流(medial-, trans-Golgi, TGN)に分かれて局在している(Fig. 2)。
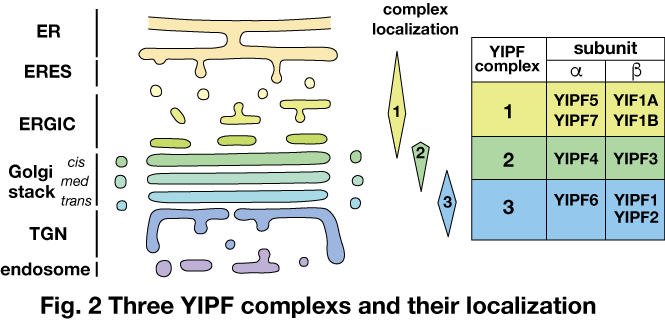
YIPFタンパク質の配列を用いてタンパク質配列データベースの検索を行ったところ,若干の例外を除いてほとんど全ての真核生物で,Saccharomyces cerevisiaeのYIPFタンパク質4種のオルソログ全てが存在することが確認された。また,動物界(Metazoa)を含むHolozoaでは,単細胞生物のSalpingocea rosettaを含めてほとんど全ての種に,ヒトYIPFのうちの6種(YIPF1, YIPF3, YIPF4, YIPF5, YIPF6, YIF1A)のオルソログが存在していた。Holozoa以外の生物では,ヒトYIPF3, YIPF4に相当するタンパク質の存在は見られず,これらのゴルジ体中流(cis-Golgi)に局在するYIPF複合体の誕生が,多細胞化と動物界の進化に重要な役割を果たした可能性が考えられた。また,硬骨魚類から哺乳類に至るTeleostomiでは,鳥類(Aves)を除いて,ヒト同様の9種のオルソログが存在していた。このことから,脊椎動物の硬骨化にこれらのホモログの増加が何らかの役割を果たした可能性が考えられた。
ゼブラフィッシュの初期発生での,ゴルジ体の構造変化とその生理的意義を解析する目的でゴルジ体マーカーであるGlcNAcTI-GFPを発現するトランスジェニックゼブラフィッシュを作成した。作成したトランスジェニックゼブラフィッシュのF1世代メスに卵殻の直径が70%程度縮小した卵を産卵する個体を見出した。この小型卵殻表現型を示す卵では,正常型に比べて強いGFP蛍光が観察された。トランスジーン産物はGlcNAcTI活性を保持していると考えられるため,小型卵殻表現型がゴルジ体でのGlcNAcTI活性上昇によって起こる可能性が示唆された。GlcNAcTI活性上昇とそれに伴う小型卵殻表現型は,(1) 高発現を導く染色体部位への組み込み,あるいは(2)複数のGlcNAcTI-GFPの組み込みによっておこる可能性が考えられる。これらの可能性を明らかにするため,まず,inverse PCR法によって組み込み部位の特定を行った。
昨年までに,小型卵殻表現型を示さないトランスジェニックゼブラフィッシュ系統は23番染色体にトランスジーンが組み込まれているが,小型卵殻表現型を示す個体のゲノムでは,23番染色体以外の部位にトランスジーンの組み込みがあることが明らかにしていた。今年度は,この組み込み部位の探索を行った。まず,生命資源環境学科の木村教授・坂本助教との共同研究によって全ゲノム解析を行ったところ,25番染色体の31514547から31514557の部位(GRCz11)へトランスジーンが組み込まれている可能性が明らかになった。PCRによって組み込み部位の特定を行ったところ,実際にトランスジーンが25染色体の31514547から31514557の部位(GRCz11)への組み込まれていることが確認された。一方,驚いたことに,小型卵殻表現型を示す雌を含むsiblingsの多くで23番および25番染色体の2カ所への組み込みが見られたことから,ゲノムの異なる部位2カ所への組み込みによるトランスジーンの高発現が小型卵殻表現型を導いた可能性が示唆された。
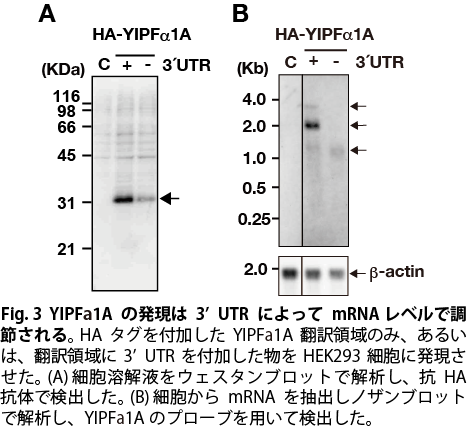
YIPFα1Aのコーディング領域にネイティブの3’UTRを付加し,HEK293細胞に一過性に発現させると,コーディング領域のみと比べて発現量が2倍以上高くなることが昨年度までに明らかとなっていた(Fig. 3A)。 ノザンブロッティングでYIPFα1AのmRNAのサイズを解析したところ,3’UTR配列の全長が転写されたと考えられる約3300 baseのバンド以外に,3’UTR配列の中央付近で転写集結したと考えられる約2000 baseのバンド,また,コーディング領域のみで転写集結したと考えられる約1000 baseのバンドの3種のバンドが検出された(Fig. 3B,矢印)。中でも,約2000 baseのバンドのシグナルは,コントロールに比較して顕著に強く,mRNAが増加していることが示唆された。3’UTRによるYIPFα1AのmRNAの発現量の変化を定量的に比較するために,qPCRによって解析したところ,コントロールに比較して3’UTRの付加により,mRNAの発現量が2.4倍に上昇していた。以上の結果から,YIPFα1Aの発現は,3’UTRの付加によってmRNAレベルで上昇することが明らかとなった。
一方,YIPFα1AのcDNA ORFには非最適コドンが多用されていることが判明したため,YIPFα1AのcDNA ORFのコドンを最適化して,YIPFα1Aの発現量が上昇するかどうかを解析したところ,予想通り,コドンの最適化によりYIPFα1Aの発現量が顕著に上昇することが明らかとなった(Fig. 4)。 以上の結果から,YIPFα1Aの発現は,非最適コドンの多用によって低く抑えられている一方で,長鎖の3’UTRの付加によってmRNAレベルで発現低下が軽減されていることが明らかとなった。非最適コドンの利用によるリボソームの停滞がmRNAの分解を誘導することや,長鎖の3’UTRの付加がmRNAの安定化を誘導することが知られている。したがって,YIPFα1Aの発現はこれらの調節機構を利用して巧妙に調節されている可能性が示唆された。今後,この調節機能の生理的意義をさらに明らかにしていく予定である。
GM130の構造変化を解析する過程で,大腸菌で発現させたGM130タンパク質の精製を行った。しかしながら,これまで用いていた抽出液(20mM Hepes-K(pH7.5)、150mM NaCl、5% Glycerol)では,再現よく可溶化できないことが明らかとなった(Fig.2右図)。前任者の条件を精査し,培養条件を検討したが,これまでの条件では十分に可溶化できなかった。そこで,抽出液の組成の再検討を行った。その結果,タンパク質安定化剤として添加していたグリセロールを抽出緩衝液から除去すると,GM130が顕著に可溶化することが明らかとなった(Fig.2左図)。今後は,可溶化したGM130を用いて,GM130各種結合タンパク質やGM130リン酸化によるGM130分子集合状態の変化を解析する。

YIPFのαサブユニットβサブユニットは2量体を形成するが,αサブユニットとβサブユニットを等量発現させないと,ゴルジ体の正しい部位に配送されない可能性がある。一方,遺伝子導入による一過性発現では,YIPFαサブユニットの発現がYIPFβサブユニットに比べて大変低く(次項参照)外来性遺伝子導入による解析が困難であった。これを克服するため,YIPFのαサブユニットとβサブユニットを等量発現するためのシステムの構築を行った。 ウイルス由来のP2A配列は,配列直後で翻訳を終了させるが,P2Aに続く同じフレームの翻訳領域を引き続き翻訳させる性質を持っている。この性質を利用して,2種のタンパク質を一つのmRNAから合成することができる(Felipe, P. et al. Trends Biotechnol 24, 68−75, 2006)。YIPFβサブユニットの翻訳領域の後部にP2Aを介してαサブユニットの翻訳領域を配置することで,YIPFのαサブユニットとβサブユニットを等量発現する発現プラスミドを作成した。予備的実験から,YIPFのαサブユニットとβサブユニットが同等の量発現できることが確認された。今後は,システムを最適化して,YIPFの局在化機構の解析に用いる。
YIPFa1Aの発現がコドンの最適化,また,3'UTRの付加により増加したことから,両者を組み合わせてさらに発現上昇が見られるかどうか検証を行った。 YIPFα1AのmRNA量は,翻訳領域のコドン最適化及び3'UTRの付加のいずれによっても増加し,また,コドン最適化した翻訳領域に3'UTRを付加すると,相加的にさらにmRNA量は増加した。一方,驚くべきことに,最適化されたYIPFa1Aの翻訳領域にYIPFa1Aの3'UTRを付加すると,予想に反して,タンパク質発現量が顕著に低下することが明らかとなった(Fig. 3)。この結果は,YIPFa1Aの3'UTRが先行する翻訳領域の翻訳効率に対応してタンパク質発現量を調節する機能を持つことを示唆している。今後はこの調節機構の解析を行う。
