京都産業大学 総合生命科学部 生命システム学科
発 生 情 報 学 研究室
Laboratory of Cell Signaling and Development (CSD Lab)
私たちは、正常細胞性のチロシンキナーゼSrcが関与する細胞機能を解析対象として、研究を行っています。Srcはその正常細胞性バージョン(c-Src)が発見されて間もない1980年前後頃から、免疫細胞や神経細胞などにおける働きが示されていました。その後、Srcファミリーと総称されるSrcによく似た遺伝子ファミリー(Yes、Fyn、Lckなどを含む)の存在が明らかにされ、個々のSrcファミリー遺伝子の組織特異的な発現状況がわかるようになった中で、Src自体はユビキタスな発現を示す存在であることが示されました。このような状況下で、私たちは1990年代の初め頃から生殖細胞である卵細胞に焦点をあてたSrcの機能解析を行うようになりました。
■ 卵細胞における受精成立の分子メカニズム
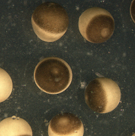
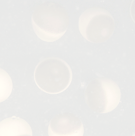
私たちはモデル実験系としてアフリカツメガエルXenopus laevisの卵細胞を用いることにしました。そしてまず、卵細胞内のSrcタンパク質(当初はエックスワイケーXykと呼んでいたが、現在はエックスサークxSrcと呼んでいる)を生化学的に同定・精製するとともに、受精に伴いそのチロシンキナーゼ活性が上昇することを明らかにしました。当時は受精に伴うチロシンキナーゼの活性化はウニ卵を用いた研究で報告があるものの、脊椎動物でははじめての例であるとともに、その分子実体を明らかにした点では生物種を越えた世界初の報告でした。その後、受精によって活性化されたSrcの生理機能の解明に重点をおいた実験を行ったところ、Srcは体細胞システムにおける基質としても知られているホスホリパーゼCγ(PLCγ)をリン酸化し活性化することで、受精時における種を越えた普遍的な現象である卵細胞内カルシウム濃度の一過的な上昇(Ca2+ transient)と、それによって誘導される卵活性化(egg activation)と呼ばれる生化学的および細胞生物学的な諸反応を誘導する働きを持つことが明らかとなりました。上の2つの写真は左側が産卵直後の未受精卵を、右側に媒精後5分を経過した受精卵を、それぞれ示しています。直径が約1.2〜1.3 mmもあるアフリカツメガエル卵細胞は、受精後数分以内でこのような肉眼でもわかる程のダイナミックな形態変化(表層収縮反応:動物極と呼ばれる色調の濃い半球面が収縮する現象)を起こします。この現象も卵活性化反応の一つです。このように、受精に伴うSrcの活性化は卵細胞に精子が接着・融合してから卵活性化に至るまでのごく短い時間帯で起こる、重要な現象であることが示されました。卵細胞Src-PLCγ経路が受精において重要であることを示す実験結果は、マウスのような哺乳類では得られていない半面、ゼブラフィッシュ(魚類)やホヤ(原索類)、ウニ・ヒトデ(棘皮類)などで幾つかの報告があります。このことをもとにして有性生殖システムの進化を考察すると、陸生動物と水生動物、あるいは体内受精と体外受精の分岐において大がかりなシグナル伝達ネットワークの再編成が起こったのではないか?と考えたくなります。
この数年来、研究室で重点的に取り組んでいるのは、Srcがいかにして受精により活性化されるのか、そして精子と卵はどのように接着し融合しているのか、という問題です。体細胞システム(正常細胞性)のSrcは、細胞外からの成長因子や環境ストレスなどのシグナルを感知するしくみ(細胞膜受容体やストレスセンサー)を介して活性化することが知られています。一方で、受精卵に伴うSrcの活性化には卵細胞のパートナーである精子が引き金として働いていることは明確である一方で、その具体的な実行因子や卵細胞側の受容体(受容システム)の分子実体は全くわかっていません。マウスでは遺伝子ノックアウトの解析から卵側でCD9と呼ばれる4回膜貫通型タンパク質が、精子側ではIzumo1と呼ばれる1回膜貫通型タンパク質がそれぞれ配偶子間膜融合に必須であることが示されています。そのため、アフリカツメガエルでも同じまたは似た分子が存在し、受精時に機能している可能性があります。私たちはこれまでに、卵細胞膜マイクロドメインに存在するウロプラキンIIIという1回膜貫通型タンパク質が精子との相互作用や、その後のSrc活性化に重要な働きをしていることを見いだすことに成功しています。今後も引き続きこのウロプラキンIIIの構造と機能を手がかりにした研究を行うことで、受精成立の分子メカニズムの全貌解明に少しでも近づきたいと考えています。
■ がん細胞におけるアポトーシス抵抗性の分子メカニズム
一般にSrcをはじめとするチロシンキナーゼの活性が細胞内で過剰に働いた場合、細胞は異常な増殖性を示すようになり、がん化する場合があると考えられています。Srcはニワトリに肉腫の生成を引き起こすラウス肉腫ウイルスの発がん遺伝子(ウイルス性Src)として発見され,次に正常なニワトリが持つ正常細胞性Srcが発見されたこととあわせて、がん遺伝子の定義・概念として重要な「機能獲得(gain-of-function)型変異により細胞をがん化する能力を持つ」という考え方の確立に貢献してきた「がん遺伝子研究のスター」です。では変異を起こしていない正常細胞性Srcは細胞内で何をしているのか?これは先に述べた卵細胞でのSrcの機能探索でも取り上げた課題ですが、私たちはヒトのがん細胞を使って別の角度からこの問題に取り組んでいます。もう少し具体的に言うと「正常細胞性Srcが、細胞のがん化やがん化した細胞の悪性化に関与する場合がある」という問題を扱っています。ヒトのがんが詳しく分子・細胞レベルで研究されるようになり、複数の遺伝子変異の蓄積ががん化の主要原因であることがわかってきました。例えば、がん抑制遺伝子として知られているp53は、がん細胞内でとても高い確率で変異を起こしている遺伝子の1つであることが知られています。このような状況下で、Srcはそれ自体に変異を起こしていない半面、がん細胞が持つ様々な特性に関与している事がわかってきているのです。
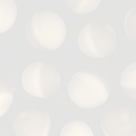
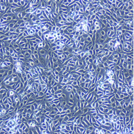
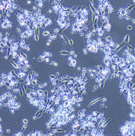
私たちはヒト膀胱がん細胞株を用いた解析から、Srcがこの細胞が示す「血清飢餓環境下での増殖性」という機能に重要な働きをしていることを見いだしました。正常細胞はもちろんのこと、ある種のがん細胞においても、それらを継代培養するときには培地中に血清成分があることが重要です。しかしながら、私たちが実験モデル細胞として使っている株(5637という)は血清がない状態でも血清がある状態とほぼ同程度の速度で増殖をすることができます。上左側の写真は、血清を含まない培地でこの細胞が培養皿いっぱいに増殖した様子を示しています。一方、上右側の写真では、血清を含まない培地中にSrc特異的阻害剤であるPP2を添加したときの細胞の様子を示しています。左の写真と同じ時間が経過しているにもかかわらず、培養皿には細胞のない隙間が多く、またよく見ると細胞の形態が異常になっています。これは細胞がアポトーシスによって死滅しつつある様子を示しているのです。このように、このがん細胞はSrcの活性に依存した「 血清飢餓環境下での増殖性」メカニズムを持っていることが示されました。
そこで現在私たちは、このがん細胞がSrcを中心としてどのような分子ネットワークによって血清飢餓環境下でのアポトーシスを回避しているのか、という点を詳細に調べようと考えて実験に取り組んでいます。そして、ここでもウロプラキンIII分子をはじめとする細胞膜マイクロドメイン局在性のタンパク質が重要な鍵を握っているらしいことが次第に明らかになってきています。血清飢餓によって作動するSrcチロシンキナーゼのシグナル伝達機構はひょっとするとアフリカツメガエル卵細胞が受精時に起こすシグナル伝達機構と似ているのかもしれない、というイメージを持ちながら実験しています。
■ ことば(随時更新および補足説明を追加予定)
Src(サーク) チロシンキナーゼ シグナル伝達 受精 卵活性化 発生開始
ウロプラキン 細胞膜マイクロドメイン 配偶子間相互作用 膜融合 生殖システム
がん細胞 がん遺伝子 がん抑制遺伝子 アポトーシス 細胞死 ストレス応答
細胞間情報伝達 細胞膜受容体
©2017 発生情報学研究室 All Rights Reserved.
研究テーマ