研究内容(けんきゅうないよう)
研究内容(けんきゅうないよう)
 はじめに
はじめに
蛋白質が正しく機能するためには、
1)ポリペプチドが正しく折りたたまれて、機能をもった高次構造を作ること、
2)機能すべき細胞内外の場に正しく輸送されること、
3)過剰に作られたり、遺伝子の変異などによって誤った構造の蛋白質が
作られた場合にそれらを監視して、分解してしまうこと、などが必要とされる。細胞は、これらの要請に応える
ために、分子シャペロンという一群の蛋白質による、きわめて巧妙な細胞機能調節機構を備えている。
従来、蛋白質はDNA上に書き込まれた遺伝情報があれば、あとは自動的に機能をもった蛋白質がつくられるものと
考えられてきた。新しく作られたポリペプチドは、もっとも安定な状態に自動的に折りたたまれると考えられてきたから
である。
しかし、ここ10年ほどの研究の進展によって、多くの蛋白質の折り畳み(folding)には、分子シャペロンの働きが
きわめて重要であることが明らかになり、分子細胞生物学領域に大きなインパクトを与えた。
蛋白質のfoldingのみならず、蛋白質の細胞内輸送や新生蛋白質の。品質管理にも、分子シャペロンが
必須の役割を果たしていることが明らかになり、今や細胞内の種々の機能およびその調節を語るのに、
分子シャペロンをはずしては語れないほどになっている。
また分子シャペロンの多くのものは、細胞に加えられた種々のストレスによっても誘導され、ストレス蛋白質
としての性質ももっている。熱ショックをはじめ、重金属の取り込み、糖鎖付加阻害や、酸素ストレス、虚血、発熱、
感染などが細胞ストレスとなる。これらストレスによって誘導されたストレス蛋白質は、細胞内で変性した蛋白質の
凝集を防いだり、変性蛋白質の再生を行ったりして、蛋白質の変性による細胞死から細胞を守っている。
このように分子シャペロン/ストレス蛋白質は、蛋白質の高次構造の制御に関わることから、近年、多くの神経変性
疾患に関与するポリグルタミンリピートをもった病態や、 プリオン病などへの研究の進展が著しく、それら病態の制御
という観点からも大きな注目を集めている。
当研究室では、次の3つの大きな柱のもとに、さらにそれらの関連研究を行っている。
・コラーゲン特異的分子シャペロンHSP47の機能解析
・小胞体品質管理機構の解析
・細胞質シャペロニンCCTの発現制御とその機能解析
当研究室の研究の特色は、いずれも当研究室で発見され、クローニングされた新規遺伝子(蛋白質)について研究を
進めている点であり、世界的にも独創性の高さを評価されている研究であると自負している。
 コラーゲン特異的分子シャペロンHSP47の機能解析
コラーゲン特異的分子シャペロンHSP47の機能解析
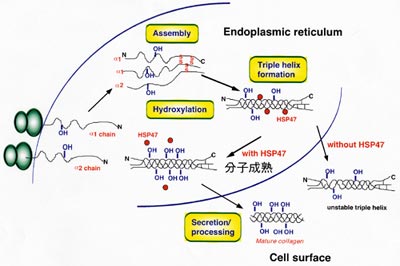
HSP47は永田によって発見されたコラーゲン特異
的分子シャペロンで、小胞体に存在している。
コラーゲンは、3本のα鎖がC末端まで翻訳された
のち、C末端から3本鎖を形成する。HSP47の遺伝
子破壊の実験などから、HSP47が無いと、コラーゲ
ンが正しい3本鎖を作ることができず、マウス胎児
の組織中には、コラーゲン繊維や基底膜が形成さ
れないことが、明らかになった。血管の破裂や、
種々の組織でのアポトーシスなどによって、マウス
胎児は胎生11目には死亡し、HSP47は「分子シャ
ペロン⇒コラーゲン分子の正しい構築⇒コラーゲン
繊維や基底膜の形成⇒正しい組織・器官形成」と
いう一連の過程のなかで、マウスの発生に必須の
シャペロンであることが明らかになった。
HSP47はまた、コラーゲンの関連する疾患(特に
繊維化を特徴とする、肝硬変、肺や腎の繊維化
疾患、動脈硬化、ケロイドなど)において、著しく
発現が昂進しており、その繊維化はHSP47のアン
チセンスRNA投与によって抑えられるという予備的な結果を得ており、HSP47の制御は難病の筆頭でもある繊維化
疾患の新しい治療戦略となる可能性をもっている。
 小胞体品質管理機構の解析
小胞体品質管理機構の解析
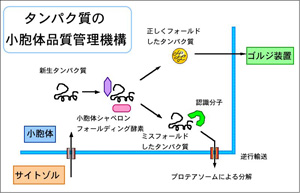
小胞体品質管理(ERQC)、小胞体関連分解(ERAD)の作用機序の
解明を、分子、細胞ならびに個体レベルで行っている。小胞体で
生合成されたタンパク質は、正しい高次構造を形成した場合に
のみ分泌経路にのることができ、フォールディングに失敗したタン
パク質は分泌されずに小胞体にとどめておかれる。この機構は、
小胞体品質管理機構(ERQC: ER quality control)と名付けられた。
小胞体に蓄積したミスフォールド蛋白質は、小胞体から細胞質に
逆輸送されて、細胞質のプロテアソームによって分解される。
この機構はERAD (ER associated degradation) と呼ばれている。
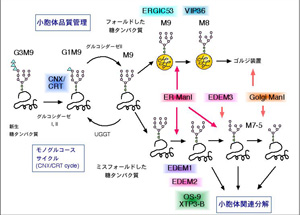
ERQC, ERADに関しては、遺伝子レベルでmutationをもった
タンパク質がERAD機構によって分解されたり、あるいはERQCの
破綻が疾患を引き起こすことが明らかにされ、臨床・疾病治療の
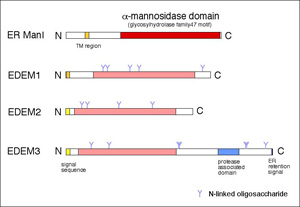
面からも注目されている。 ERADに関わるEDEMホモログタンパク
質(ER degradation enhancing- mannosidase-like protein)は、
酵母では1種類、哺乳類では3種類あることが明らかになってい
る。いずれも糖タンパク質のERADを促進するが、その分子メカニズ
ムは異なっているようなので、その違いを明らかにするとともに、
EDEMファミリーを包括する機能の解明を行いたいと考えている。
また最近、さらに、ERQCにおけるN結合型糖鎖の役割、タンパク質
の小胞体からの逆行輸送に関与する分子、小胞体膜上でタンパク
質をユビキチン化する分子の研究など、独自の視点に立った研究
を進めている。
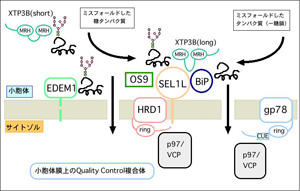
最近、新規小胞体レクチンタンパク質XTP3-BおよびOS-9が、
小胞体膜に存在するユビキチンリガーゼと複合体を形成し、
ミスフォールドタンパク質品質管理の足場を提供していることを
明らかにした。この新規レクチンが認識する糖鎖構造を生化学的
に解析することによって、糖鎖認識を介した小胞体品質管理機
構の解明を行っている。
 細胞質シャペロニンCCTの発現制御とその機能解析
細胞質シャペロニンCCTの発現制御とその機能解析
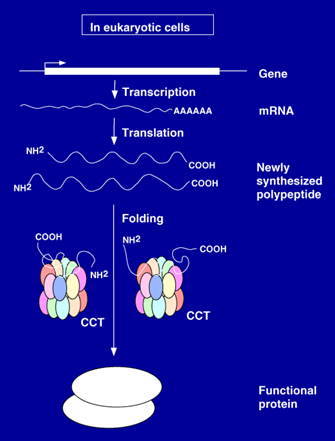
細胞質シャペロニンCCTは、ヒトをはじめとして全ての真核
生物の細胞質に存在する必須の分子シャペロンであり、
生合成直後のアミノ酸鎖が折り畳んで(フォールディング)
機能型の高次構造をとるために非常に重要な働きを行うこと
が知られている。例えば、アクチンやチューブリンといった
タンパク質は、CCT無しではフォールディングすることができ
ないので、これらの蛋白質は成熟できず、その結果として
細胞は死んでしまう。CCTは、大腸菌のGroELやミトコンドリ
アのHSP60とアミノ酸配列の類似性を共有し、シャペロニン
ファミリーと呼ばれるグループの一員であるが、8種類もの
サブユニットを持つ点が他のシャペロニンとは大きく異なって
いる。CCTは8種類ものサブユニットを使って非常に巧妙に
進化したシャペロン機能をもつものと予想されている。
前助手の久保田は、10年ほど前より細胞質シャペロニンCCT
の研究を行って来た(10年前はTCP-1という名前で呼ばれ
ていた)。この間に、まず、マウスCCTのもつ8種類すべての
サブユニットcDNAをクローニングすることに成功し、その一次
構造を決定した。さらに、これらをプローブとして、マウスCCT
サブユニットのゲノム遺伝子の全てを単離しその塩基配列を
決定した。また、CCTの発現が細胞増殖と強く相関している
ことを見いだし、また、8つのうちの一つのサブユニット遺伝子
を制御する転写因子の同定にも成功している。
近年CCTは、最も研究の進んでいる分子シャペロンの一つ
である大腸菌GroELに対する真核生物におけるホモローグ
として注目を集めており、一流科学雑誌にも関連論文が
しばしば掲載されている。CCTの機能を解明することは、
タンパク質のフォールディングや分子シャペロン研究の進歩に大きく貢献するものと期待される。
現在、我々は、ヒトやマウスの細胞を用いて、CCTサブユニット遺伝子を制御する転写因子や細胞内における
CCTの機能について研究を行っている。世界的にもCCTの8種類全てのサブユニットとその遺伝子の全てを
扱える研究室は我々の研究室をおいて他にないと考えられる。
この複雑で巧妙な分子シャペロンの機能の解明をめざし、今後は、研究テーマの中心を、
CCT複合体そのものや8種類もあるサブユニットそれぞれの機能の解析へとシフトさせて行くことを計画している。